Mi a kálium elektronikus konfigurációja?
Milyen a kálium elektronikus konfigurációja? Annak érdekében, hogy ezt a kérdést megválaszoljuk, fontoljuk meg az atom szerkezetét, valamint az elektronok eloszlásának szabályait a szintek és alsóbb szintek felett.
Kvantummechanika
A kálium elektronikus konfigurációját ismertetjükSchrodinger-egyenlet. Ez összeköti a mag és az elektronok kölcsönhatásának potenciális energiáját, valamint az egyenlő töltésű részecskék közötti repulzust. A kvantummechanika ebből az egyenletből kiindulva feltételezi, hogy minden energiaszintre vonatkozóan egy bizonyos energia tartalék létezik.

Sok elektronatom
A kálium elektronikus konfigurációját aa Pauli tilalom elve. Figyelembe véve az elektron hullámtermészetének sajátosságait, feltételezte, hogy minden negatív részecske az "orbitális", vagyis bizonyos térbeli létezésen van. Ami a sok elektron atomot illeti, amelyhez a kálium tartozik, mindegyik orbitálison legfeljebb két elektron helyezhető el. Ennek eredményeképpen négy kvantumszámot azonosítottak, amelyek jellemzik az elektron állapotát a figyelembe vett időintervallumban.

A Klechkovsky-szabály
A kálium elektronikus konfigurációja a következőkből áll:a Klechkovsky által vezetett szabály alapja. Nézzük részletesebben. Attól függően, hogy melyik orbitális elektron található, bizonyos mennyiségű energiával rendelkeznek. Először is, kisebb energiatartalommal rendelkező részecskék vannak eloszlatva.
Ennek elsődleges elektron energia jellemző szolgál a főkvantumszám számának megfelelő az időszak.
Egy multi-elektron atomon, nem csakvonzása az elektronok magjához, hanem a köztük lévő repulzió. A részecskék teljes centrifugálásának növekedésével az elektronhéj energiája csökken, és nő az elektronok száma, amelyek a mozgás sajátosságainak azonos tájolásával nőnek. A kvantumkémia hasonló függését Hund-szabálynak nevezik.
E két szabály alapján,a káliumatom elektronikus konfigurációja. Az atomi spektrumok lehetővé teszik az elektronok alapállapotának meghatározását, vagyis azon részecskék azonosítását, amelyek minimális energia tartalékot tartalmaznak.
A multielectron káliumatom elektronikus képletének létrehozása lényegében egyszerű: az elektronikus rendszernek minimális energiával kell rendelkeznie, összhangban a Pauli kizárási elvével.
Példák az elektronok energiaszinten való eloszlására
Mielőtt megfontolná, mi az elektronikusa káliumion konfigurációját, egyszerű példákat adunk. A hidrogénatomban a mag tartalmaz egy pozitív protonot. A mag körül egy elektron elfordul a pályán. A földi állapotban a hidrogén elektronikus képletje a következő: 1s. Vizsgáljuk meg ennek az elektronnak a spin orientációját. A Hund szabálya szerint a sejtmag hátsó részével van kapcsolatban.
Az elemtáblában második számmal rendelkező hélium esetén két elektron található egy pályán. Mindegyiknek ½ centrifugálással, másik forgási iránya van.
A második energia szint elemei két héjjal rendelkeznek, mindegyiknek saját energiaellátása van.
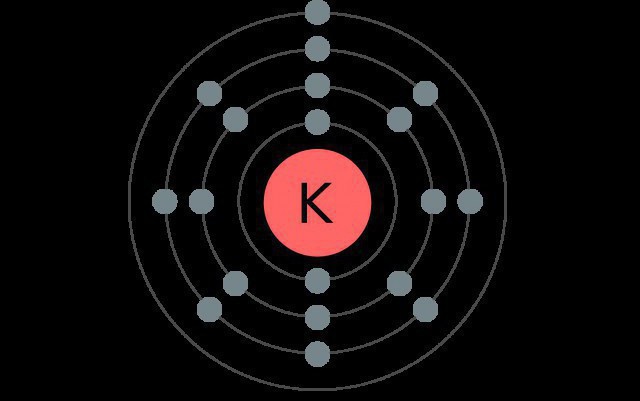
A kálium az elemrendszer rendszerének negyedik időszakának egyik eleme, ezért négy elektronikus szinten van, amelyek mindegyike különböző alsóbb szinteket tartalmaz.
Normál állapotban ennek az alkálifémnek az atomja a következő konfigurációjú: 1s22s22p63s23p64s1.
A káliumion elektronikus konfigurációja különbözikaz atomtól. A fém külső energiaszinten egy valencia elektron van. Mivel a kálium a redukáló tulajdonságokat mutatja, a más atomokkal való kölcsönhatások során valenciál elektronot ad, pozitív iontá alakul (kation), amely a következő elektronikus konfigurációval rendelkezik: 1s22s22p63s23p64s0.

következtetés
Minden egyes kémiai elem esetében,Az időszakos táblában található elektronikus konfigurációkat a Hund-szabály, a Pauli-tilalom elve és a Klechkovsky-képlet segítheti. A szervetlen kémiai atomok elektronikus konfigurációi mellett a kémiai kölcsönhatások eredményeként képződött kationok és anionok képlete is kialakul.








